Berichte
Verlässlich & sicher: Impfstoffherstellung in Europa
EU-Staaten wie Österreich und Dänemark wollen die Produktion von Impfstoffen ausbauen. Die Verfahren der Europäischen Arzneimittelagentur (EMA) und Österreichs AGES Medizinmarktaufsicht garantieren die Qualität und Sicherheit der zugelassenen Impfstoffe, bekräftigt der Österreichische Verband der Impfhersteller (ÖVIH).
Qualitätsstandards
Die Impfstoffe werden mittels eines zentralisierten Verfahrens der EMA überprüft. Der ÖVIH nennt die Vorteile: die Arzneimittel sind zeitgleich für alle 450 Millionen EU-Bürger erhältlich, es gibt klar definierte rechtliche Standards und zudem Entscheidungen, die auf etablierten wissenschaftlichen Bewertungsgrundlagen basieren.
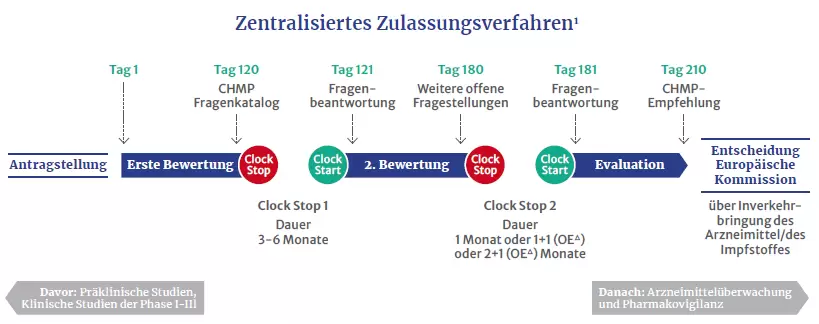
Zulassungsverfahren
Die Prüfung durch die Europäische Arzneimittel-Agentur dauert in der Regel rund ein Jahr. Dabei muss das potenzielle Medikament drei Phasen durchlaufen. Dazu gehören auch zwei Bewertungsphasen, die laut ÖVIH rund 180 Tage dauern. Zwischen den Bewertungen erfolgen sogenannte Clock-Stops, in denen die Unternehmen etwa Fragen der EMA beantworten. Abschließend wird die Zulassung durch Repräsentanten aller EU-Arzneimittelbehörden ausgesprochen oder verwehrt. Ausschlaggebend ist eine Nutzen-Risiko-Bewertung auf Basis aller vorgelegten Daten.
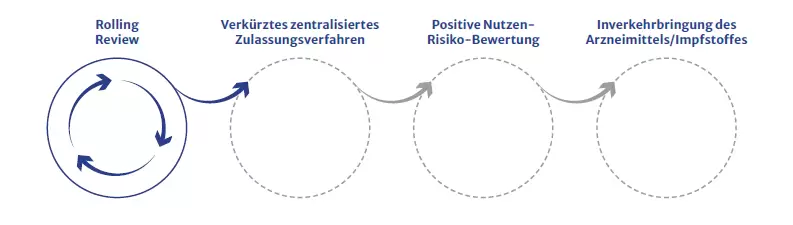
Rolling-Review Prozess
Der Rolling-Review Prozess beschleunigt die Begutachtung von wissenschaftlichen Daten. Dabei werden die eingereichten Daten des Impfstoff-Herstellers bereits kontrolliert, bevor alle formalen Unterlagen für die Antragstellung eingereicht wurden. Dieser Prozess ist auf zwei Wochen begrenzt. Das garantiert eine rasche Rückmeldung an den Impfstoff-Hersteller. Durch den Rolling-Review Prozess kann das Zulassungsverfahren stark verkürzt werden, um dringend benötigte Arzneimittel und Impfstoffe – wie den COVID-19 Impfstoff – rasch auf den Markt zu bringen.